
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
IX CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XVI - 2000 - pág 35 a 43.
RESUMEN
Las aplicaciones de las proteasas son múltiples: tiernización de carnes, elaboración de cerveza, producción de quesos, panificación, obtención de proteínas modificadas para su uso en alimentación humana y animal, manufactura de cueros, polvos detergentes, procesado de fibras textiles y tratamiento de afluentes industriales, además de su utilización por parte de la industria farmacéutica. De acuerdo a la información disponible, nuestro país importaría la totalidad de las proteasas que utiliza la industria. En el presente trabajo se exponen las propiedades más destacadas de las fitoproteasas aisladas hasta el momento en nuestro laboratorio y se brinda un marco de referencia acerca de la posibilidad de su explotación y uso por parte de la industria nacional.
Proteases have a wide range of applications: meat tenderization, beer, cheese, and bread elaboration, production of modified food proteins, lead manufacture, detersive industry, industrial wastes treatment, pharmaceuticals, etc. In keeping with up to date information, Argentina imports the bulk of the proteases used by the industry. The present work gives a short description of the properties of the proteases isolated in our laboratory and aims to encourage the use and production of them.
INTRODUCCIÓN
Las enzimas que desempeñan el rol central en la degradación de las proteínas han sido conocidas tradicionalmente como "proteasas", término equivalente al de "enzimas proteolíticas" y también al más moderno de "péptido-hidrolasas". Por otra parte, durante la discusión de los mecanismos de acción hidrolítica surgieron los nombres alternativos de endopeptidasas (o proteinasas) para las que ejercen su acción en el interior de las cadenas polipeptídicas y de exopeptidasas (o peptidasas) para las que hacen lo propio a partir de los extremos, términos que manifiestan una obvia analogía con los que se usan para designar a las hidrolasas que actúan sobre otros biopolímeros (1).
Las proteinasas difieren de casi todas las demás enzimas en que su especificidad de sustrato resulta extremadamente difícil de definir, hecho que llevó a Hartley (2) a proponer una clasificación de las mismas basada en las características de sus respectivos mecanismos catalíticos. A partir de esa propuesta las endopeptidasas se dividen en cuatro grupos: proteinasas serínicas (EC 3.4.21), tiolproteinasas (EC 3.4.22, actualmente denominadas proteinasas cisteínicas), proteinasas ácidas (EC 3.4.23, modernamente llamadas proteinasas aspárticas) y metaloproteinasas (EC 3.4.24), a los que debe agregarse un quinto grupo (EC 3.4.99) de existencia efímera, que incluye a proteinasas de mecanismos catalíticos aún no identificados (3).
Cada una de las cuatro clases de endopeptidasas mencionadas posee un mecanismo catalítico distintivo, pero aún así pueden agruparse en dos grandes categorías: las que forman complejos covalentes entre la enzima y el sustrato (endopeptidasas serínicas y cisteínicas) y las que no forman complejos enzima-sustrato covalentes (endopeptidasas aspárticas y metaloproteinasas). A pesar de las diferencias señaladas, debe tenerse en cuenta que el proceso principal -la escisión de la unión peptídica- es idéntico en todos los casos y que las diferencias entre los mecanismos catalíticos son mas bien sutiles. Los grupos específicos que llevan a cabo las distintas etapas de la proteólisis son diferentes en las cuatro clases de endopeptidasas mencionadas, pero el resultado neto es el mismo (4).
PRINCIPALES APLICACIONES DE LAS PROTEASAS
Tiernización de carnes
Como la mayoría de los productos naturales, las enzimas proteolíticas han sido utilizadas empíricamente durante mucho tiempo, especialmente en materia de alimentación y salud. Un buen ejemplo lo constituye el empleo del jugo de mamón (Carica papaya), con el que los habitantes de muchas regiones de Centro y Sudamérica hacen más tiernas las carnes que consumen. Las proteasas contenidas en dicho jugo provocan la tiernización por hidrólisis parcial de las proteínas del tejido conectivo (colágeno y elastina) y en menor grado las de las mismas fibras musculares. Si bien las proteasas pueden aplicarse de muy diversas maneras, actualmente en la industria de la carne se logra un excelente tiernizado inyectando por vía endovenosa al animal antes de ser faenado una solución de enzima reversiblemente inactivada. La proteasa es reactivada por el poder reductor que adquiere el músculo luego de la muerte (5) y manifiesta su máxima actividad con el incremento de la temperatura durante el proceso de cocción (6). Con este tratamiento también se mejora la digestibilidad del producto.
Elaboración de cerveza
Otra aplicación importante de las proteasas es el uso que se hace de ellas en la industria de la cerveza, con el objeto de proporcionar a la misma una buena estabilidad coloidal a bajas temperaturas, evitando que como consecuencia del enfriamiento se manifieste turbiedad o que sedimenten componentes que se mantenían solubles a temperatura ambiente. El fenómeno anterior es debido a la presencia de un complejo tanoproteico (tanino-proteína) que resulta soluble en caliente o a temperatura ambiente, pero que tiene tendencia a precipitar en frío. Tanto las proteínas como los compuestos polifenólicos provienen de las materias primas usadas en la preparación de la cerveza (cebada y lúpulo). Un modo de resolver el problema es impedir la formación del complejo o digerirlo parcialmente luego de formado; en este último caso se usan enzimas proteolíticas, en especial papaína, aunque también se han ensayado ficina, bromelina y pepsina. Debe tenerse en cuenta que la hidrólisis requiere ser controlada, ya que la cerveza debe mantener una adecuada proporción de proteína coloidal, necesaria para que la misma tenga "cuerpo" y produzca espuma abundante y duradera (7).
Elaboración de quesos
Las proteasas se utilizan en la industria láctea, en especial en la fabricación de quesos. La quimosina, una endopeptidasa que integra los fermentos gástricos de los rumiantes, ha sido tradicionalmente usada para producir la coagulación de la leche. Este proceso ocurre en dos etapas, la primera de las cuales es de naturaleza enzimática y consiste fundamentalmente en la hidrólisis de una unión peptídica específica de la kappa-caseína (8), haciéndola susceptible a coagular englobando lípidos y proteínas, en presencia de Ca^+ y calor (lo que constituye la segunda etapa). Como sustituyentes de la quimosina se han ensayado otras enzimas: pepsina bovina y porcina, ficina y proteasas fúngicas de Mucor miehei, M. pusillus y Endothia parasítica, aunque su uso no se ha generalizado.
Panificación
Durante la panificación se adicionan proteasas fúngicas (Aspergillus oryzae), papaína o bromelina para mejorar la manipulación de la masa, así como su elasticidad y la textura del gluten, lo que finalmente provoca un incremento sustancial del volumen de aquélla, con la consiguiente reducción del tiempo de amasado (7).
Obtención de proteínas modificadas para la industria alimentaria
La hidrólisis cambia las propiedades químicas, físicas, biológicas e inmunológicas de las proteínas. La hidrólisis de las proteínas alimenticias es llevada a cabo por varias razones, incluyendo la mejora de las características nutricionales, el retardo del deterioro, la modificación de las propiedades funcionales (solubilidad, espuma, capacidad de coagulación y de formación de espuma), prevención de interacciones indeseables, cambio de aromas y sabores y remoción de factores tóxicos o inhibitorios. La hidrólisis enzimática es decididamente preferida en relación a los métodos químicos porque produce hidrolizados con perfiles peptídicos perfectamente definidos y evita la formación de D-aminoácidos y de sustancias tóxicas como la lisino-alanina (9,10).
Un ejemplo interesante es la producción de quesos modificados por enzimas (Enzyme Modified Cheeses, EMC), los que tienen un sabor 5 a 15 veces más intenso que los quesos no modificados. Estos EMC se utilizan como agentes saborizantes reemplazando total o parcialmente el ingrediente original en la fabricación de productos que normalmente contienen quesos (11).
Por otra parte, la hidrólisis parcial de las proteínas permite modificar ciertas propiedades fisicoquímicas de las mismas: así es como se ha logrado incrementar la solubilidad de las proteínas de semillas de soja (12), algodón (13) y maní, casos en los que han resultado adecuadas papaína, bromelina y ficina (14). Los productos obtenidos pueden emplearse en la elaboración de bebidas, sopas y salsas. En cuanto al incremento de la capacidad emulgente. se obtuvieron buenos resultados con proteínas de soja y de trigo para su uso en mayonesas, salsas y aderezos (15). Es de particular importancia el incremento del poder espumígeno de las proteínas para ser utilizadas en la fabricación de "souffles", "mousses", merengues, helados y cremas. En tal sentido se han obtenido proteínas modificadas que producen espumas abundantes y estables a partir de semillas de soja y trigo.
También se obtienen por degradación enzimática hidrolizados proteicos, los que han encontrado creciente aplicación como aditivos alimentarios, yaque proveen aminoácidos libres y péptidos de bajo peso molecular (11).
Aditivos en polvos detergentes
Una aplicación de las proteasas que ha adquirido gran importancia en los últimos tiempos es su incorporación a polvos detergentes (16), en los que están habitualmente asociadas a lipasas y amilasas, siendo las de origen microbiano las más utilizadas.
Manufactura de cueros
Otro importante proceso industrial en el que se emplean enzimas proteolíticas es la manufactura de cueros, ya sea en la etapa previa de la depilación de la piel como en la posterior del "batido", cuyo objetivo es preparar el cuero para el teñido y que consiste en la remoción de restos de pelos, glándulas, células epiteliales y tejidos superficiales no separados por los tratamientos previos. En este caso se utiliza principalmente pancreatina, pero también se han ensayado con buenos resultados papaína, bromelina y proteasas bacterianas (en especial la obtenida de Bacillus subtilis) y fúngicas de variado origen (7).
Industria textil
A los efectos de aumentar la resistencia a la tracción y a la abrasión, las fibras textiles son "encoladas" con una preparación de polímeros ("colas"). Con posterioridad al hilado se debe proceder a "desencolar" los hilos para restituir las propiedades de los mismos. Las fibras artificiales son habitualmente impregnadas con gelatina y para su desencolado se usa la proteasa neutra de Bacillus subtilis o la proteasa alcalina de B. licheniformis (7).
Industria farmacéutica
Las enzimas proteolíticas han sido utilizadas en tratamientos post-quirúrgicos para el desbridamiento de heridas y en clínica médica gastroenterológica como coadyuvantes en el tratamiento de trastornos digestivos, en este último caso asociadas a otras enzimas hidrolíticas (17). Pero la aplicación más trascendente de las mismas obedece a sus probadas propiedades antiinflamatorias (18), siendo papaína, bromelina y ficina las proteasas más ampliamente utilizadas en tal sentido.
Informaciones relativamente recientes han dado cuenta de una presunta actividad citostática de la bromelina (19-21), pero el anuncio no ha sido confirmado por posteriores investigaciones. Mucho más recientemente se ha ensayado en el tratamiento de hernias de discos intervertebrales la aplicación local de quimopapaína inyectable, que actuaría hidrolizando los proteoglicanos presentes en los núcleos pulposos ("quimionucleolisis") responsables de la afección (22).
Tratamiento de efluentes industriales
Se trata de una aplicación más reciente y está relacionada con la degradación biológica de efluentes industriales que contengan proteínas, como ocurre en el "agua de cola" que se produce en la etapa del prensado del material durante el procesamiento de harinas de pescado.
El tratamiento con proteasas alcalinas reduce la viscosidad de los efluentes facilitando su transporte a través de los conductos de desagote y al mismo tiempo provee de un material más fácilmente procesable por los microorganismos responsables de su degradación final, lo que constituye un aporte a favor de la reducción de la contaminación ambiental que habitualmente genera el quehacer industrial (23).
IMPORTANCIA ECONÓMICA DE LAS PROTEASAS
En términos económicos, las enzimas proteolíticas representan casi las dos terceras partes de las enzimas que se comercializan en el mercado mundial (17,23), incluidas tanto las de origen vegetal como las de origen animal o microbiano. A fines de 1990 el comercio mundial de enzimas había superado holgadamente los 500 millones de dólares, habiéndose previsto en ese momento un crecimiento del 5% anual (23), que de haberse concretado llevaría aquella cifra al orden de los 600-700 millones de dólares para 1994, de los cuales no menos de 400 millones correspondería a las proteasas.
En lo que se refiere a nuestro país, la importación de proteasas prácticamente se duplicó entre 1992 y 1994 (tabla 1), alcanzando en este último año un valor cercano al 1 % de lo comercializado en todo el mundo (24).
La tabla no tiene en cuenta la calidad del material importado (su grado de pureza), porque este dato no estaba consignado en la fuente disponible (24), hecho que puede distorsionar el análisis. Un ejemplo de ello lo constituye la colagenasa, que en 1992 representó casi el 10% (173,4 miles de dólares) del monto total importado, pero sólo el 0,007% (5 kg) de la cantidad total, con un valor exhorbitante para una proteasa de calidad industrial (34.000 dólares el kg.), por lo se presume que en este caso se trata de una proteasa de alto valor agregado (es decir, muy purificada). El valor de las proteasas de uso industrial oscila entre 5,5 y 86,7 dólares por kg. (valor este último que corresponde a la colagenasa cuando se importan cantidades mayores).
ESTUDIOS DE FITOPROTEASAS EN ARGENTINA
En principio, toda proteasa está capacitada para degradar cualquier sustrato proteico, aunque el grado de hidrólisis alcanzado y el tipo de productos obtenidos no sean los mismos prácticamente en ningún caso. La elección de una u otra clase de proteasa dependerá entonces de su modo de acción y de la posibilidad de que el mismo se adapte a las condiciones particulares del proceso en el que se intente aplicarla (pH, temperatura, fuerza iónica, presencia de otras sustancias, características del medio).
Como ya ha sido mencionado, las enzimas proteolíticas representan casi las dos terceras partes de las enzimas que se comercializan en el mercado mundial, pero sin embargo el número de proteasas de aplicación industrial no supera la docena, incluidas tanto las de origen vegetal (papaína, ficina, bromelina) como las de origen animal (pancreatina, pepsina, quimosina) o microbiano (alcalasa, neutrasa, proteasas fúngicas). Por ello resulta sorprendente el aún reducido número de proteasas que a la fecha han sido aisladas, purificadas y caracterizadas (25).
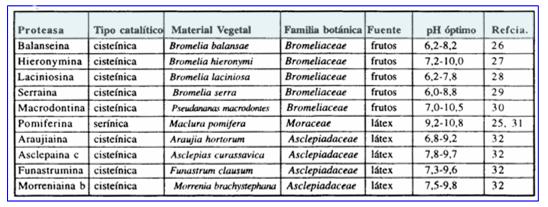
En el caso de las plantas superiores, el número de especies investigadas en tal sentido está muy lejos de representar siquiera el uno por mil de las especies conocidas. En lo que se refiere a la Argentina, la variedad de zonas fitogeográficas existentes ha generado una importante flora autóctona, a la que debe sumarse un buen número de especies introducidas por cultivo. Sin embargo no existen antecedentes sobre el aislamiento de fitoproteasas provenientes de plantas que crecen en el país, a excepción de los estudios realizados en nuestro laboratorio sobre algunas especies de Bromeliaceae, Moraceae y Asclepiadaceae, cuyas características principales se resumen en la Tabla 2.
CONCLUSIONES
El mercado mundial de enzimas ha adquirido una creciente importancia, estimándose en alrededor de setecientos millones de dólares el monto comercializado en 1994. La mayoría de las enzimas de interés industrial son hidrolasas, representando las proteasas las dos terceras partes de las mismas.
La mayor parte de las proteasas que utiliza actualmente la industria son de origen microbiano (inicialmente enzimas extracelulares codificadas en el genoma microbiano y más recientemente enzimas de organismos superiores obtenidas por ingeniería genética), pero muchas enzimas proteolíticas de origen vegetal (papaína, ficina, bromelina) siguen siendo preferidas en muchos casos (debe tenerse en cuenta que cada enzima suma a su especificidad catalítica condiciones de actividad y estabilidad que le son características y que pueden decidir su preferencia en uno u otro proceso). Sin embargo el número de fitoproteasas estudiadas es considerablemente reducido, ya que las especies analizadas en tal sentido no alcanzan al 1% de las especies conocidas de plantas superiores.
De acuerdo a los datos disponibles, Argentina importa probablemente la totalidad de las proteasas que consume, no existiendo en el país ningún intento de producción de fitoproteasas a partir de especies silvestres o cultivadas, a pesar de que algunas de las proteasas estudiadas (25) estarían en condiciones de ser obtenidas a bajo costo en elevado estado de pureza y podrían ser ensayadas como sustitutos de algunas de las proteasas que actualmente importa la industria.
Agradecimientos
Claudia Natalucci y Néstor Caffini pertenecen a la Carrera del Investigador de la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CIC), Ma. Cecilia Arribére es becaria de perfeccionamiento de CIC y Laura M.I. López es becaria post-doctoral de CONICET. El presente trabajo ha recibido apoyo de CONICET (PID-BID 1119), CIC y de la Secretaría de Ciencia y Técnica de la Universidad Nacional de La Plata.
Tabla 1: Importación de proteasas durante el período 1992-1994 (Fuente: Instituto Nacional de Estadísticas y Censos)
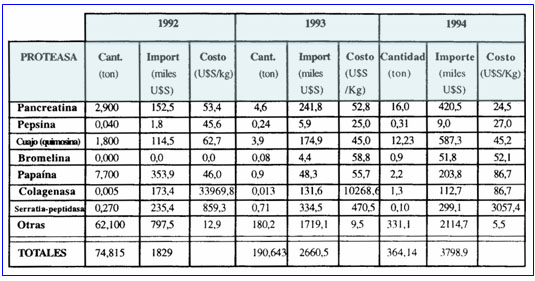
Tabla 2: Fitoproteasas estudiadas en el Laboratorio de Investigación de Proteínas Vegetales (LIPROVE), Facultad de Ciencias Exactas de la Universidad Nacional de La Plata, Argentina.
|
|
|